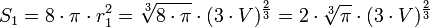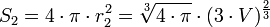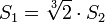Tension superficielle - Définition
La tension superficielle, ou énergie d'interface, ou énergie de surface, est la tension qui existe à la surface de séparation de deux milieux.
Cet effet permet par exemple aux insectes de marcher sur l'eau, à la rosée de ne pas s'étaler sur les pétales de fleurs, et explique la capillarité. La tension superficielle explique aussi la formation des bulles de savon.
Mécanisme
Interface liquide/gaz
Au sein d'un fluide (liquide ou gaz), les molécules exercent entre elles des forces d'attraction ou de répulsion : force de Van der Waals (attraction), force électrostatique (attraction ou répulsion). On parle de " forces intermoléculaires ".
Si l'on considère un corps pur liquide, composé d'un seul type de molécules, les molécules s'attirent (sinon, elles ne formeraient pas une phase). Au sein du liquide, chaque molécule est tirée dans toutes les directions par les molécules voisines de liquide : la résultante des forces est nulle.
Dans le vide, une molécule n'est, par contre attirée par rien. Donc, à la frontière liquide/vide, les molécules sont attirées côté liquide mais pas côté vide ; la résultante des forces s'exerçant sur les molécules de la surface est donc dirigée vers l'intérieur du liquide. Ceci tend la surface.
- Dans le cas d'une interface liquide/vide, c'est donc un effet au sein d'un liquide qui amène la surface à se déformer comme une membrane élastique.
Mais on sait que soumis au vide, une partie du liquide s'évapore (voir l'article Pression de vapeur saturante). Si cette pression de gaz est faible, le liquide est soumis à une faible compression, et les molécules de la surface sont également soumises à une faible attraction de la part de leurs paires de la phase gazeuse ; mais la densité du gaz étant très inférieure à celle du liquide, cette attraction est négligeable.
Si maintenant il y a un autre gaz au-dessus (par exemple de l'air), le phénomène est similaire. Le liquide est soumis à la pression du gaz, et les molécules à la surface du liquide sont soumises à l'attraction ou à la répulsion de la part des molécules du gaz. Du fait de la faible densité du gaz par rapport au liquide, on néglige en général cette dernière contribution.
La forme de la surface résulte donc de l'équilibre entre la pression du gaz, l'attraction par l'intérieur du liquide, et le poids si l'on est en présence de pesanteur.
Notons que le liquide peut être sous la forme d'une pellicule ; cette pellicule est alors soumise à la pression du gaz des deux côtés. Si les forces d'attraction au sein du liquide sont faibles, la pellicule ne tient pas. À l'inverse, si ces forces sont fortes, la pellicule tient bien et a un comportement élastique (bulle de savon).
Interface liquide/liquide
Lorsque deux liquides A et B sont miscibles, il forment une seule phase. Par contre, s'ils sont non miscibles, ils forment deux phases séparées.
S'ils sont non miscibles, c'est que les molécules se repoussent. Les molécules situées à l'interface sont donc soumises :
- pour les molécules de A :
- à une attraction vers l'intérieur du liquide A ;
- à une répulsion de la part des molécules de B ;
- pour les molécules de B :
- à une attraction vers l'intérieur du liquide B ;
- à une répulsion de la part des molécules de A.
On voit donc que la résultante des forces est située vers l'intérieur de chacun des liquides dans tous les cas.
La forme de l'interface est donc déterminée par
- les forces d'attraction au sein des liquides, A/A et B/B ;
- la force de répulsion entre A et B ;
- la pesanteur le cas échéant.
C'est le cas de l'eau et de l'huile, de la vinaigrette :
- soit l'huile forme une couche au-dessus de l'eau ;
- soit l'huile forme des gouttelettes au sein de l'eau (émulsion).
Interface triple : Le contact solide – liquide – vapeur
On est souvent en présence d'une interface triple solide/liquide/gaz, par exemple
- goutte posée sur un solide ;
- goutte suspendue à un solide ;
- bord d'un verre.
Les interactions liquide/gaz on été décrites ci-dessus.
De même, les molécules du liquide peuvent être attirées ou repoussées par les molécules du solide. La forme de l'interface au niveau du point triple va donc être déterminée par :
- la force d'attraction au sein du liquide ;
- l'attraction ou la répulsion de la part du solide ;
- la pression du gaz, et éventuellement l'attraction ou la répulsion par le gaz ;
- la gravité.
S'il y a attraction entre le liquide et le solide :
- la goutte posée sur le solide va avoir tendance à s'étaler ;
- la goutte suspendue va être retenue ;
- le liquide va remonter le long du verre (ménisque, capillarité).
S'il y a répulsion entre le liquide et le solide :
- la goutte posée sur le solide va avoir tendance à " se regrouper ", à prendre une forme sphérique ;
- la goutte suspendue va tomber ;
- le liquide va s'incurver vers le haut.
Des composés permettent de diminuer la tension superficielle, ce sont des tensioactifs.
Modélisation
La tension superficielle se mesure en newtons par mètre (N·m-1). On la définit comme la force qu'il faut appliquer à l'unité de longueur le long d'une ligne perpendiculaire à la surface d'un liquide en équilibre pour provoquer l'extension de cette surface, ou comme le travail exercé par cette force par unité de surface. L'unité de tension superficielle (N·m-1) est équivalente à des joules par mètre carré (J·m-2), qui correspondent à une unité d'énergie de surface. On peut définir cette énergie d'interface comme étant le surplus d'énergie chimique par rapport au cas où les molécules de surface se trouveraient à l'intérieur du liquide.
Le système tend à minimiser l'énergie de surface.
Liquides non miscibles
Dans le cas d'une goutte d'un liquide A au sein d'un liquide B, l'énergie est minimale lorsque la surface est minimale. Or la forme correspondant à la plus petite surface possible est une sphère. C'est pour cela que les gouttes d'eau ont une forme circulaire.
Si deux gouttes se rencontrent, elles vont fusionner et ainsi former une seule goutte (coalescence), toujours pour minimiser la tension superficielle. En effet, deux sphères de volume
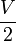
- une sphère de volume
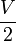
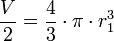
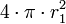
-
- Une sphère de volume V a un rayon vérifiant
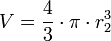
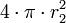
-
- soit
-
Dans ce cas-là, l'énergie globale de l'interface ne dépend que de l'aire de l'interface. Si l'on appelle σ la tension superficielle (densité d'énergie de surface), alors l'énergie nécessaire à créer l'interface est :
- WS = σ·S.
Liquide sur un solide
Si l'énergie d'interface entre un solide et un liquide est forte, alors le liquide ne s'étale pas et reste sous forme de gouttelette.
Expériences
Un certain nombre d'expériences simples permettent de mettre en évidence la tension superficielle
- ménisque de l'eau dans un verre : lorsque l'on met de l'eau dans un verre, l'eau remonte d'environ un millimètre le long de la paroi ; ceci est particulièrement visible dans le cas d'un tube à essai (environ 1 cm de diamètre) ; ou, à l'inverse, on peut faire dépasser la surface de l'eau du bord du verre sans qu'elle ne s'écoule en dehors de celui-ci.
- goutte qui pend sans tomber : c'est la tension superficielle qui retient la goutte au support ; la masse de la goutte qui tombe d'un compte-goutte est donnée par la loi de Tate
- propulsion à l'huile ou au savon ;
- Un liquide peut monter dans un tube fin : loi de Jurin
- fontaine de soda : dans un soda, les molécules du gaz carbonique dissout sont solvatées, les molécules d'eau forment un bouclier autour du CO2 ; si l'on secoue la bouteille, on vainc la tension superficielle du bouclier et les molécules de CO2 se regroupent pour former des bulles ; ou bien en utilisant une poudre, les petits grains abaissent la tension superficielle, on peut par exemple mettre des chewing-gums (voir aussi (en) Menthos fountain).
Valeurs
Les valeurs suivantes sont tirées du polycopié de Broch :
- eau
- 0 °C : σ = 7,6·10-2 N·m-1 ;
- 20 °C : σ = 7,3·10-2 N·m-1 ;
- 37 °C : σ = 7,0·10-2 N·m-1 ;
- plasma sanguin, 37 °C : σ = 7,3·10-2 N·m-1 ;
- eau + surfactant pulmonaire : 2,5·10-2 N·m-1 ;
- mercure, 20 °C : σ = 4,36·10-1 N·m-1.
Source : Flow Science inc.
- eau + huile à 20 °C : σ = 2,0·10-2 N·m-1 ;