Indicateur de pH - Définition
La liste des auteurs de cet article est disponible ici.
Quelques indicateurs courants
Voici une liste non exhaustive des principaux indicateurs utilisés en chimie ou en biologie. Les valeurs des transitions et les teintes peuvent varier légèrement en fonction des conditions d'utilisation (solvants, température, pression, etc.).
| Indicateur | Couleur (acide) | Transition (approximativement) | Couleur (base) |
|---|---|---|---|
| Bleu de bromothymol, BBT (1re transition) | rose-rouge | ≈0,0 | jaune |
| Rouge de crésol (acide - 1re transition) | rouge | 0,0-1,0 | jaune |
| Méthyl violet | jaune | 0,0-1,6 | bleu-violet |
| Vert malachite (acide - 1re transition) | jaune | 0,2-1,8 | bleu-vert |
| Bleu de thymol (acide - 1re transition) | rouge | 1,2-2,8 | jaune |
| Jaune de méthyle | rouge | 2,9-4,0 | jaune |
| Bleu de bromophénol (BBP) | jaune | 3,0-4,6 | violet |
| Rouge congo | bleu | 3,0-5,2 | rouge |
| Méthyl orange (Hélianthine) | rouge | 3,1-4,4 | jaune |
| Méthyl orange en solution dans le xylène cyanole | pourpre | 3,2-4,2 | vert |
| Vert de bromocrésol | jaune | 3,8-5,4 | bleu |
| Rouge de méthyle | rouge | 4,2-6,3 | jaune |
| Papier de tournesol (Azolitmine) | rouge | 4,5-8,3 | bleu |
| Pourpre de bromocrésol | jaune | 5,2-6,8 | violet |
| Bleu de bromothymol, BBT (2e transition) | jaune | 6,0-7,6 | bleu |
| Rouge de phénol (Phénolsulfonephtaléine) | jaune | 6,6-8,0 | rouge |
| Rouge neutre | rouge | 6,8-8,0 | jaune orangé |
| Rouge de crésol (base - 2e transition) | jaune | 7,2-8,8 | rouge |
| Bleu de thymol (base - 2e transition) | jaune | 8,0-9,6 | bleu |
| Phénolphtaléine | incolore | 8,2-10,0 | rose |
| Thymolphtaléine | incolore | 9,4-10,6 | bleu |
| Jaune d'alizarine R | jaune | 10,1-12,0 | orange-rouge |
| Alizarine | rouge | 11,0-12,4 | violet |
| Carmin d'indigo | bleu | 11,4-13,0 | jaune |
| Vert malachite (base - 2e transition) | bleu-vert | 11,5-13,2 | incolore |
Aspects techniques
Nature acido-basique des indicateurs
Un indicateur coloré peut être considéré comme un couple acide faible/base faible (selon la définition de l’acidité de Brönsted). On notera InH la forme acide d’un indicateur et In- sa forme basique. L’équilibre acide-base existant entre ces deux formes est donc :
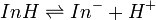
![K_i = \frac{\left[In^- \right]\left[ H_3O^+ \right]} {\left[ InH \right]}](https://static.techno-science.net/illustration/Definitions/autres/4/40462c536cf6a5aa120eeeed0c0e4cee_665aa10d3b629a726a7dad604b22b035.png)
où [X] est la concentration de l’espèce X en mol.l-1
On utilise plus souvent le pKi qui est égal au cologarithme décimal du Ki : pKi = − logKi Chaque indicateur est caractérisé par le pKi de son couple ou par plusieurs pKi s’il s’agit d’un polyacide.
- Détermination expérimentale du pKi d'un indicateur coloré
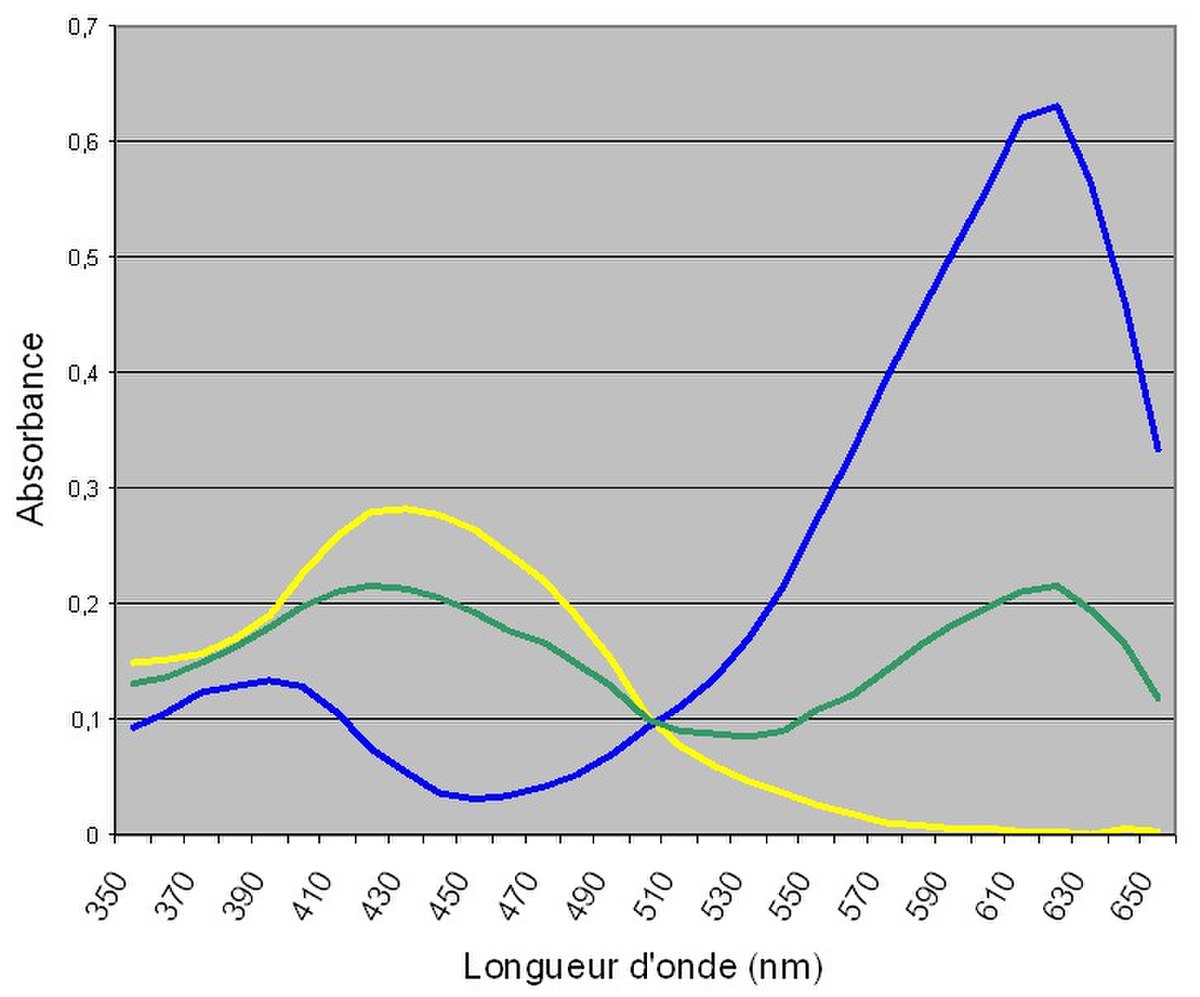
Les mesures spectrophotométriques permettent de déterminer expérimentalement le pKi d’un indicateur coloré.
D’après la loi de Beer-Lambert, on sait que l’absorbance A (sans unité) d’une solution, mesurée dans un spectrophotomètre ou colorimètre, est proportionnelle à :
- Un coefficient d’absorption molaire ελ intrinsèque à la substance et à une longueur d’onde λ (en cm-1.l.mol-1);
- L’épaisseur l de solution traversée par le rayon de l’appareil (i.e. l’épaisseur de la cuve, en cm) ;
- La concentration c de la surface absorbante (en mol.l-1) :
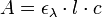
D’autre part, la définition originelle de l’absorbance est :
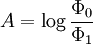
Φ0 et Φ1 sont les flux lumineux indicent et transmis lors du passage dans le spectrophotomètre.
Si le faisceau de l’appareil traverse deux solutions de coefficient ελ(1) et ελ(2) et de concentrations c1 et c2, on a :
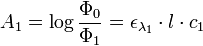
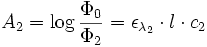
Étant donné que l’absorbance est une grandeur additive, on a au final :
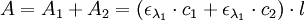
Appliquons donc ce principe aux indicateurs colorés. En exploitant les courbes d'absorbance des différentes formes d'un indicateur coloré, réalisées expérimentalement, on détermine la longueur pour laquelle la différence d’absorbance entre les deux formes de l’indicateur est la plus grande.
Par la suite, on détermine l’absorbance à cette longueur d’onde d’une nouvelle solution, tamponnée à un pH proche de celui attendu pour le pKi. On peut utiliser les relations de Beer-Lambert pour chacune des deux solutions acides et basiques pour déterminer les coefficients d’absorption et ensuite déterminer par le calcul la concentration de chaque forme de l’indicateur :
![c_{In} = \left[InH\right] + \left[In^-\right]](https://static.techno-science.net/illustration/Definitions/autres/6/61848be641675da0f8bad6420c737734_08c18d3b4ffde52ab514195368485bc2.png)
![A = \epsilon_{\lambda_{(InH)}}\cdot l \cdot \left[ InH \right]](https://static.techno-science.net/illustration/Definitions/autres/7/7322c1f11bf4a53a7d01deba1f73dd30_964ec34154262fda77b57193d63be199.png)
![A = \epsilon_{\lambda_{(In^-)}}\cdot l \cdot \left[ In^- \right]](https://static.techno-science.net/illustration/Definitions/autres/8/8396107e4816432ab8e41073ae297e3c_bb4a5314f0c10b9381c1ba031eb7feb0.png)
L'absorbance de la solution en milieu tamponné, où les deux formes cohabitent, est donc donnée par :
![A = A_{InH} + A_{In^-} = \left( \epsilon_{\lambda_{(InH)}} \cdot \left[ InH \right] + \epsilon_{\lambda_{(In^-)}} \cdot \left[ In^- \right] \right) \cdot l = \left( \epsilon_{\lambda_{(InH)}} \cdot \left[ InH \right] + \epsilon_{\lambda_{(In^-)}} \cdot \left( c - \left[ InH \right] \right) \right) \cdot l](https://static.techno-science.net/illustration/Definitions/autres/3/32b86969006da73cd6f7e0d364272af0_f1b3ae47a0ac0b21bd8431f367830e1f.png)
[InH] est la seule inconnue, on en déduit donc aussi [In-]. Reste à déterminer le pKi du couple InH/In- :
![K_i = \frac{ \left[ In^- \right]_{tampon} \left[ H_3O^+ \right]_{tampon}} {\left[ InH \right]_{tampon}}](https://static.techno-science.net/illustration/Definitions/autres/7/7e639c9551322ea977ac55c7480fb988_7bc574b7404acfbfcd365d80adc789a9.png)
![pK_i = pH_{tampon} - \log {\frac{ \left[ In^- \right]_{tampon}} {\left[ InH \right]_{tampon}}}](https://static.techno-science.net/illustration/Definitions/autres/d/dfe5f9685a10389cfa04cf03a84256d4_416238004a33bdb8afa25e7cd44aa22e.png)
Aspects mécanistiques
Une espèce chimique est colorée à partir du moment où elle peut absorber sélectivement des photons à certaines longueurs d’ondes du spectre visible. Elle émet donc de la lumière visible. L’énergie d’absorption du composé est inversement proportionnelle à la longueur d’onde du maximum d’absorption, chaque longueur d’onde d’absorption correspondant à une longueur d'onde d’émission et donc à une couleur. Les molécules colorées sont constituées de l’association de deux types de groupements d’atomes :
Les groupes chromophores
Ils permettent à la molécule de se situer à des énergies d’absorption proches du visible. Il s’agit le plus souvent de systèmes d’électrons conjugués (c’est-à-dire des alternances entre orbitales σ et orbitales π, n ou p). Chaque type de transition électronique (entre orbitales π liantes, n non liantes et π* antiliantes) correspond à des énergies d’absorption différentes (tableau suivant) :
| Groupe chromophore | Transition électronique | Absorption maximale λmax (nm) |
|---|---|---|
| Alcène C=C | π → π* | 180 |
| Carbonyl C=O | π → π* | 180 |
| Benzène C6H5 | n → π* π → π* | 277 200 - 255 |
| Azo N=N | n → π* | 347 |
| Nitroso N=O | n → π* | 665 |
La longueur d'onde du maximum d’absorption augmente lorsque le nombre d’électrons délocalisés, et donc impliqués dans un système conjugué, augmente lui aussi
Lors d’un virage acide-base, un indicateur coloré change de forme. Sa nouvelle structure possède donc des énergies d’absorption différentes, sa couleur change.
Les groupes auxochromes
Les électrons non partagés de groupes appelés auxochromes tels que –OH, –OCH3, –NH2, –Cl, –N(CH3)2, peuvent se coupler aux groupements chromophores et ainsi influencer sur la couleur des molécules. C’est donc l’origine des différences entre les couleurs des composés présentant la même structure de base.
Catégories d'indicateurs de pH
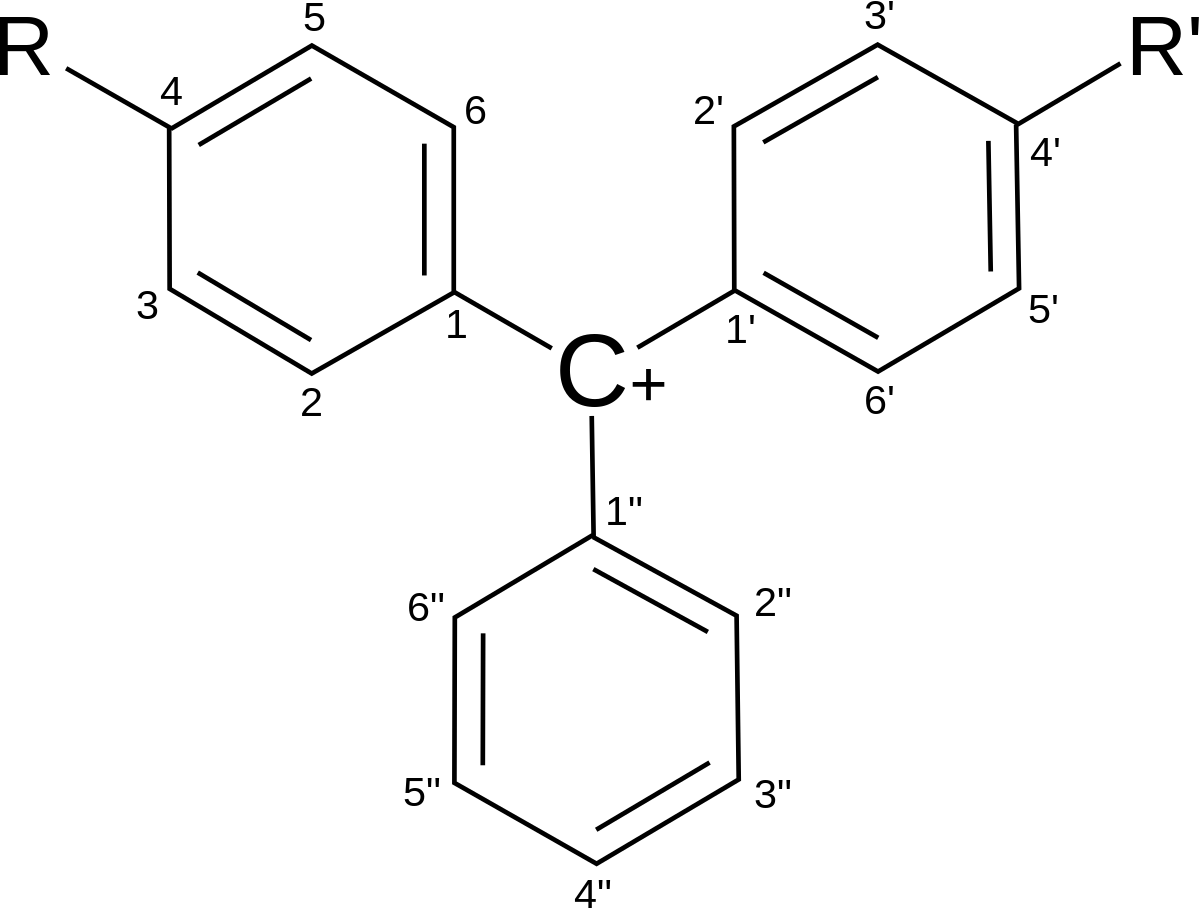
Les indicateurs colorés acide-base classiques peuvent être classés principalement selon deux catégories : ceux dérivant du triphénylméthane et ceux dérivant de l’azobenzène. Ces structures permettent un grand nombre de délocalisations d’électrons π, les groupements venant se greffer sur cette structure pouvant augmenter la conjugaison du système.
Triphénylméthane
Plusieurs groupes fonctionnels différents peuvent se positionner en para sur les deux cycles principaux – voire le troisième assez rarement – et ce, du fait de la délocalisation de la charge positive pouvant être portée par le carbone central du triphénylméthane. Il s’agit donc généralement de bases de Lewis possédant un doublet libre d’électrons, c'est-à-dire des composés azotés ou hydrogénés. D’autres groupements peuvent se placer sur les autres positions des deux premiers cycles.
On peut parfois observer la présence d’un cycle lactone R-CO-O-R' entre la position 2" et le carbone central. C’est le cas des phtaléines.
Un cycle sulfonate R-SO2-O-R' est quant à lui présent entre les mêmes positions dans les molécules du bleu de bromothymol, de bromophénol, du vert de bromocrésol… Ces composés sont regroupés au sein d’une famille appelée les sulfonephtaléines (ou simplement sulfones, lorsque l’on est dans un contexte d’indicateurs de pH).
| Nom \ Position | 2" | 2 | 3 | 4 | 5 | 2' | 3' | 4' | 5' |
|---|---|---|---|---|---|---|---|---|---|
| Bleu de bromothymol | SO3- | Me | Br | OH | MeEt | Me | Br | OH | MeEt |
| Bleu de bromophénol | SO3- | H | Br | OH | Br | H | Br | OH | Br |
| Vert de bromocrésol | SO3- | Me | Br | OH | Br | Me | Br | OH | Br |
| Rouge de crésol | SO3- | H | Me | OH | H | H | Me | OH | H |
| Phénolphtaléine | CO2- | H | H | OH | H | H | H | OH | H |
| Thymolphtaléine | CO2- | Me | H | OH | MeEt | Me | H | OH | MeEt |
| Vert de malachite | H | H | H | NMe2 | H | H | H | NMe2 | H |
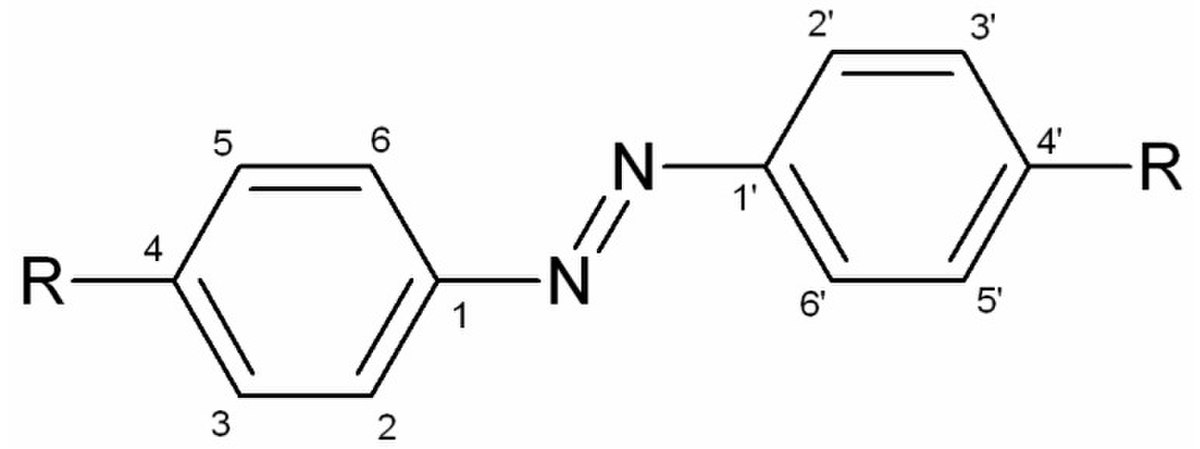
Azobenzène
Nombreuses sont les molécules colorées qui ont pour structure de base celle du 1,2-diphénylazène, plus connu sous le nom d’azobenzène. Toutefois, ces composés sont bien plus connus en tant que teintures ou colorants que par leurs propriétés halochromiques. Ces molécules sont dites azoïques. De manière analogue aux dérivés du triphénylméthane, des groupements peuvent se positionner en para principalement puis en ortho et méta.
Parmi ces groupements, on peut trouver d’autres cycles, par exemple, pour former des naphtalènes mais aussi d’autres groupes azoïques. Ces derniers engendrent des molécules qualifiées de diazoïques.
Seuls les indicateurs présents dans le tableau ci-dessous sont réellement utilisés malgré le grand nombre de molécules de ce type.
| Nom \ Position | 2 | 3 | 4 | 5 | 4' |
|---|---|---|---|---|---|
| Hélianthine | H | H | SO3- | H | NMe2 |
| Rouge congo | NH2 | naphtyl | SO3- | sym | |
| Rouge de méthyle | CO2H | H | H | H | NMe2 |
| Jaune de méthyle | H | H | NMe2 | H | H |
| Jaune d'alizarine R | H | CO2H | OH | H | NO2 |
Autres composés halochromiques
Il existe, bien sûr, d’autres types d’indicateurs colorés. On peut citer :
- Les anthocyanines : présentes dans la nature, notamment dans le chou rouge, mais aussi dans certaines fleurs (bleuet, delphinium…) ou dans plusieurs baies (myrtilles).
- Quelques dérivés de l’anthracène, le xanthène, la pyridine ou d’autres composés polycycliques.
- Quelques composés aromatiques nitratés tel que les nitrophénols, nitrobenzènes ou nitrotoluènes.
- D’autres composés atypiques, souvent naturels et dérivant parfois des anthocyanes.
Mais seuls les dérivés du triphénylméthane et de l’azobenzène sont utilisés en chimie à titre d’indicateur acido-basique.