Énergie d'ionisation - Définition
Le potentiel d'ionisation ou énergie d'ionisation d'un atome ou d'une molécule est l'énergie nécessaire pour lui arracher un électron. Plus généralement, la nième énergie d'ionisation est l'énergie requise pour arracher le nième électron après que les n − 1 premiers électrons aient été arrachés. En Chimie physique, le concept d'énergie d'ionisation est l'inverse de celui d'affinité électronique, c'est-à-dire de sa propension à céder ou au contraire à retenir un électron.
La réaction d'ionisation de l'atome A s'écrit :
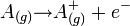
Généralités
L'énergie d'ionisation s'exprime en eV ou en Joule ou en kiloJoule/mole (kJ/mole). 1 électron-Volt est très proche de 100 kJ/mole. C'est une grandeur qui est toujours positive, ce qui signifie qu'il faut toujours fournir de l'énergie à une atome pour lui arracher un (ou plusieurs) électrons. L'énergie d'ionisation varie en fonction de l'atome ou de la molécule considérée, ainsi que de son état d'ionisation.
On peut ioniser un atome possédant plus d'un électron en plusieurs étapes. Par exemple, un atome de bore cinq électrons : deux dans une couche interne (1s2) et trois dans la couche de valence(2s2 et 2p1). L'énergie d'ionisation d'ordre n est l'énergie nécessaire pour séparer successivement n électrons de l'atome. L'énergie de première ionisation varie beaucoup selon les atomes. L'énergie d'ionisation augmente le long d'une ligne de la table périodique des éléments période puis diminue brusquement lorsque l'on passe à une autre ligne.
L'électron arraché que l'on considère dans le concept d'énergie d'ionisation provient de la couche de valence. Mais il peut se faire qu'un électron des couches profondes de l'atome soit arraché sans que les électrons des couches superficielles l'aient été préalablement; dans ce cas les électrons se réorganisent ensuite, donnant lieu à un rayonnement (fluorescence X).
Valeurs numériques des énergies d'ionisation
D'une façon générale, les énergies d'ionisation décroissent le long d'une colonne de le Tableau périodique des éléments et croissent de gauche à droite le long d'une ligne de la table. L'énergie d'ionisation montre une forte anticorrélation avec le rayon atomique. Les énergies d'ionisation successives d'un élément donné augmentent progressivement, comme on peut le voir sur le tableau ci-dessous. L'augmentation est particulièrement forte lorsqu'après l'épuisement complet d'une couche d'orbitale atomique, on passe à une nouvelle couche . Ceci vient du fait que lorsque tous les électrons d'une orbitale ont été extraits, l'énergie d'ionisation suivante consistera à extraire un électron d'une orbitale plus proche du noyau, là où la force électrostatique qui lie l'électron au noyau est plus intense.
Dans le tableau ci-dessous, on donne quelques valeurs pour la troisième ligne de la table périodique.
| Élément | premier | Second | Troisième | Quatrième | Cinquième | Sixième | Septième |
|---|---|---|---|---|---|---|---|
| Na | 496 | 4 560 | |||||
| Mg | 738 | 1 450 | 7 730 | ||||
| Al | 577 | 1 816 | 2 881 | 11 600 | |||
| Si | 786 | 1 577 | 3 228 | 4 354 | 16,100 | ||
| P | 1 060 | 1 890 | 2 905 | 4 950 | 6 270 | 21 200 | |
| S | 999.6 | 2 260 | 3 375 | 4 565 | 6 950 | 8 490 | 27 107 |
| Cl | 1 256 | 2 295 | 3 850 | 5 160 | 6 560 | 9 360 | 11 000 |
| Ar | 1 520 | 2 665 | 3 945 | 5 770 | 7 230 | 8 780 | 12 000 |
L'énergie d'ionisation est un bon indicateur pour déterminer combien d'électrons possède un élément donné sur sa couche externe. Il convient d'observer à partir de combien d'ionisations successives se produit le saut significatif correspondant au passage de la couche externe à la couche suivante. Par exemple, si il faut 1 500 kJ/mole pour arracher un électron et 5 000 kJ/mole pour arracher le deuxième, et ensuite 6 000 kJ/mole pour le troisième, cela veut dire que la couche externe possède un électron unique. C'est donc un métal qui cédera facilement un électron. Une fois qu'un octet stable a été constitué, il devient beaucoup plus difficile d'arracher le suivant, mais par contre, une fois que cet électron a été retiré, le suivant sera légèrement plus facile à arracher.
Interprétation électrostatique et modèle semi-classique
L'énergie d'ionisation atomique peut être calculée à partir du Potentiel électrique et du modèle de Bohr d'un atome.
On considère un électron de charge -e et un ion avec une charge +ne, où n est le nombre d'électrons manquant à l'ion. Selon le modèle de Bohr, si l'électron s'approchait, il pourrait rester lié à l'atome à un certain rayon a. Le potentiel électrostatique V à la distance a du noyau s'écrit :
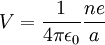
étant entendu que le zéro du potentiel est référencé à l'infini.
Comme l'électron est chargé négativement, il est attiré par ce potentiel positif. (C'est le potentiel d'ionisation). L'énergie nécessaire pour sortir du puits de potentiel et quitter l'atome est donnée par :
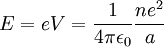
C'est l'énergie d'ionisation, qui est égale au potentiel d'ionisation si elle est exprimée en électron-volts
À ce stade de l'approche classique, l'analyse est encore incomplète puisque la distance a reste une variable inconnue. Il convient alors d'associer à chaque électron d'un élément chimique donné une distance caractéristique choisie de telle sorte que l'expression du potentiel d'ionisation soit en accord avec des données expérimentales.
Une approche semi-classique basée sur l'hypothèse de Bohr étend la validité du modèle classique en quantifiant la quantité de mouvement. Cette approche est très bien vérifiée pour l'atome d'hydrogène qui n'a qu'un seul électron. L'intensité du moment angulaire pour une orbite circulaire est :
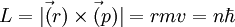
L'énergie totale de l'atome est la somme de ses énergies potentielle U et cinétique T, c'est-à-dire :
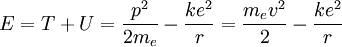
La vitesse peut être éliminée du terme correspondant à l'énergie cinétique en posant que l'attraction coulombienne doit être compensée à la force centrifuge :
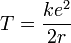
Ce qui permet alors d'exprimer l'énergie en fonction de k, e, and r.
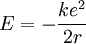
La quantification de la quantité de mouvement exprimée quelques lignes plus haut selon l'hypothèse de Bohr permet alors d'écrire :
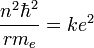
D'où l'on tire la relation entre n et r :
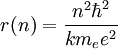
On appelle le rayon de Bohr a0 le rayon pour lequel n est égal à 1. On peut alors exprimer l'équation de l'énergie en faisant appel au rayon de Bohr :
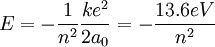
On peut étendre ce modèle à d'autres noyaux que celui de l'hydrogène en introduisant le numéro atomique dans l'équation.
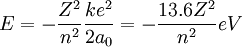
L'approche simple mais rigoureuse de Feynman
L'inconvénient de l'approche semi-classique, qui fait l'hypothèse implicite d'un électron en orbite autour du noyau, avec la force centrifuge qui s'oppose à la force d'attraction, à l'instar d'un satellite en orbite est qu'il est avéré depuis le début du XXe siècle qu'elle est erronée : un électron en orbite ne manquerait pas de rayonner, et s'effondrerait sur le noyau suivant une trajectoire en spirale. Feynman a montré qu'il n'était pas nécessaire de faire cette hypothèse pour estimer le rayon du noyau d'hydrogène :
En rappelant que l'énergie totale du système noyau + électron est
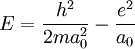
"Nous ne savons pas ce que vaut a0, mais nous savons que l'atome va s'arranger pour faire une sorte de compromis de façon que son énergie soit aussi petite que possible", écrit Feynman dans son célèbre "Lectures on Physics"[1]
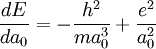
En écrivant que la valeur de cette dérivée est nulle, on obtient la valeur de a0
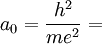
L'énergie d'ionisation en mécanique quantique
Le modèle de Bohr n'est pas tout à fait conforme à la théorie de la mécanique quantique, mieux décrite par le Modèle de Schrödinger selon laquelle la localisation de l'électron est décrite non pas de façon déterministe, mais comme un "nuage" de localisations dotées d'une certaine probabilité d'être plus ou moins près du noyau. Cette approche plus rigoureuse est également un plus compliquée, mais on peut donner quelques pistes pour l'aborder : Le nuage correspond à une fonction d'onde ou, plus précisément à une combinaison linéaire des déterminants de Slater, c'est-à-dire, selon le Principe d'exclusion de Pauli, des produits antisymétriques des Orbitale atomique ou des Orbitale moléculaire. Cette combinaison linéaire est un développement en interaction de configurations de la fonction d'onde électronique.
Dans le cas général, pour calculer la nième énergie d'ionisation, il faut soustraire l'énergie d'un système de Z − n + 1 électrons d'un système de Z − n électrons. Le calcul de ces énergies n'est pas simple, mais il s'agit d'un problème assez classique de ce que l'on appelle la chimie computationelle, c'est-à-dire l'étude de la chimie par numérisation numérique. En première approximation, l'énergie d'ionisation peut être déduite du théorème de Koopmans
Notes et sources de l'article
Dans sa version de février 2007, cet article doit beaucoup à l'article correspondant de la wikipedia en langue anglaise.

















































