Cinétique chimique - Définition
La cinétique chimique est l'étude de la vitesse des réactions chimiques.
Certaines réactions sont totales et très rapides voire violentes, comme les explosions. D'autres sont tellement lentes qu'elles durent plusieurs années (comme la formation de la rouille), voire plusieurs siècles (comme la formation du charbon ou du pétrole). Certaines sont même tellement lentes que les réactifs de départ sont considérés comme stables, par exemple l'oxydation de l'aluminium ou encore la transformation du diamant en carbone graphite. On parle alors d'états " métastables ".
Pour mesurer l'avancement de la réaction, on utilise le taux d'avancement ζ, défini comme le rapport de la quantité de réactif déficitaire ayant disparu à l'instant t, sur la quantité initiale de ce réactif au temps t0 (ζ = 0 avant réaction, ζ = 1 lorsque la réaction est totale ).
On définit la vitesse de réaction par la dérivée du taux d'avancement par rapport au temps v = dζ/dt. Si la réaction a lieu dans les proportions stoechiométriques on peut définir ζ par rapport à un quelconque des réactifs de départ; il n'y a pas de réactif déficitaire.
Importance et intérêt de la cinétique chimique
Importance pratique
Connaitre la vitesse des réactions chimiques et être capable de la calculer est de toute première importance dans toutes les applications de la Chimie.
Quelques exemples :
- La vitesse de combustion des mélanges utilisés dans les moteurs à explosion, les réacteurs d'avions, les moteurs fusées.
- La vitesse de prise des colles, des ciments, de polymérisation, de durcissement.
- La vitesse de dégradation des matériaux, des substances actives dans un médicament.
- La vitesse des réactions chimiques mises en oeuvre dans les usines de production de produits chimiques.
- Les vitesses d'absorption, d'action et d'élimination des médicaments (pharmaco-cinétique)
- Dans l'environnement, la vitesse de formation et d'élimination de polluants atmosphériques
- etc..
La mauvaise maîtrise de la vitesse de réactions peut entrainer des catastrophes : réactions qui "s'emballent", explosions.
Intérêt théorique
La cinétique chimique permet d'établir des lois de vitesse (voir plus loin) qui servent à valider ou infirmer des hypothèses sur les mécanismes des réactions chimiques.
Facteurs influençant la vitesse des réactions
La vitesse des réactions est sous la dépendance de plusieurs facteurs. On peut citer
-
- la température,
- la quantité des réactifs présents (en solution c'est la concentration des réactifs qui intervient),
- la pression pour les réactions en phase gazeuse,
- le degré de mélange des réactifs (ségrégation),
- la présence d'un catalyseur qui peut accélérer la réaction.
Le facteur le plus important est la température, l'énergie thermique permet en effet dans de nombreux cas de franchir la barrière énergétique. Un autre paramètre important est l'état de la matière. De ce point de vue, les réactions les plus favorisées sont les réactions entre les liquides miscibles, et les réactions entre les gaz : en effet, les réactants sont dans une même phase et peuvent donc facilement entrer en réaction. Dans tous les autres cas, on a à faire à des systèmes hétérogènes, c'est-à-dire les réactions entre
- un solide et un gaz ;
- un solide et un liquide ;
- un solide et un solide ;
- un liquide et un gaz ;
- deux liquides non miscibles ;
la réaction ne peut avoir lieu qu'aux surfaces de séparation des phases (interfaces). Lorsque les produits sont fractionnés, la réaction est plus rapide, c'est la cas notamment des
- aérosols (fines gouttelettes de liquide dans un gaz) ;
- émulsions (fines gouttelettes d'un liquide dans un autre liquide, dans le cas de liquides non miscibles) ;
- mélanges de poudres finement broyées (fins grains de solides) ;
- lysoles (poudre dans un liquide) ;
- mousses et écumes (bulles dans un liquide).
En effet, dans le cas de la matière fractionnée, la surface de contact entre les réactants est importante, donc les possibilités de réaction nombreuses. Pour les solides, on quantitife ceci par la surface spécifique, qui est la surface libre par unité de masse ; une poudre, un solide poreux ou un mousse (filaments imbriqués) ont une grande surface spécifique. Lorsque les réactants ne sont pas dans le même état (par exemple solide-gaz, solide-liquide, liquide-gaz), on parle de réaction hétérogène.
Cas de l'activation thermique : barrière énergétique et température
Pour que la réaction ait lieu au sein d'un gaz, il faut que les molécules se " destructurent " pour se restructurer. Considérons le cas simple où la destructuration nécessite un choc important (activation uniquement thermique, sans catalyse, sans intervention d'autre source d'énergie comme la lumière) ; l'énergie cinétique requise est appelée " énergie d'activation ", elle correspond à la hauteur d'une " barrière énergétique " entre l'état initial (les réactifs) et l'état final (les produits).
L'énergie cinétique moyenne des molécules vaut 3/2·kT, où k est la constante de Boltzmann (voir aussi l'article Théorie cinétique des gaz), mais toutes les molécules n'ont pas la même énergie cinétique, on peut modéliser la dispersion de la valeur de l'énergie cinétique par une statistique de Maxwell-Boltzmann.
Si l'on appelle Ea cette énergie d'activation, la probabilité pour qu'un choc mette en jeu des énergies cinétiques suffisantes pour franchir la barrière d'activation est donnée par le facteur
On a retrouve donc la forme de la loi d'Arrhenius. On retrouve des lois similaires au sein des liquides ainsi que dans certaines réaction hétérogènes (liquide/solide, gaz/solide ou liquide/solide), puisque l'on a un phénomène d'agitation similaire.
À l'inverse, si une cinétique suit une loi d'Arrhénius, on peut en déduire que le phénomène est activé thermiquement.
Loi de vitesse et Ordre de réaction
Considérons une réaction dont l'équation bilan s'écrit : a·A + b·B → c·C
a et b étant les coefficients stœchiométriques qui sont des entiers naturels.
La vitesse de réaction est définie par :
Cette vitesse est fonction des concentrations des réactifs. L'étude expérimentale de la réaction permet d'établir la forme de la loi de vitesse.
Dans certains cas, la loi de vitesse peut se mettre sous la forme d'un monôme :
![v = k \cdot [{\rm A}]^\alpha \cdot [{\rm B}]^\beta](https://static.techno-science.net/illustration/Definitions/autres/9/97a4fe2cf7e48fba2b3023a9b2e205e3_6e5798ec294f178ea060063d8ff93eae.png)
A noter que α et β ne sont pas nécessairement égaux aux coefficients stœchiométriques, il ne sont même pas nécessairement entiers ni positifs.
Le coefficient k est appelé coefficient de vitesse et dépend de la température.
Si la loi de vitesse ne peut pas se mettre sous la forme d'un monôme avec les concentrations comme facteurs, on dit que la réaction n'admet pas d'ordre.
Cinétique d'une réaction élémentaire
Une réaction est dite élémentaire si les réactifs réagissent simultanément en un même point pour donner directement les produits sans former d'espèces intermédiaires. La vitesse de réaction dépend donc de la probabilité de rencontre des réactifs donc de la fréquence des chocs. Cette fréquence est proportionnelle à leur concentration. Par ailleurs, plus la température est élevée, plus les rencontres sont probables (agitation thermique) et plus l'énergie cinétique des réactifs au moment du choc est élevée ce qui permet de franchir la barrière d'activation, donc la température a également un rôle important.
On appelle molécularité le nombre d'entités (molécules, ions) qui entrent en contact lors d'une réaction élémentaire. Les réactions élementaires sont dites monomoléculaires, bimoléculaire ou trimoléculaire selon la valeur de leur molécularité (respectivement 1, 2 ou 3). Comme la probabilité que plus de 3 entitées se trouvent simultanément en un même point est quasiment nulle, on considère qu'il n'existe pas de réaction élémentaire de molécularité supérieure à 3. (La probabilité de chocs triples étant elle-même très faible, l'exitence de réactions élémentaires trimoléculaires est discutée).
Pour une réaction élémentaire, son ordre est égal à sa molécularité.
Par exemple pour une réaction élémentaire : A + B → C (bimoléculaire) La loi de vitesse prendrait la forme :
![v = \frac{-dn_A}{dt} = k \cdot [{\rm A}]\cdot [{\rm B}]](https://static.techno-science.net/illustration/Definitions/autres/e/e74db135aac34ad2bbadd51af80ed9a9_eb5b80cac869a30546f391f1ee47d587.png)
Les réactions composées
Au cours d'une transformation chimique, plusieurs réactions élémentaires peuvent avoir lieu simultanément ou successivement. On appelle réaction composées des ensembles de réactions élémentaires qui se combinent selon un des trois schéma simples suivants: série, opposé ou parallèle.
Réactions séries
Le ou les produit(s) d'une réaction peuvent eux même être les réactifs d'une autre réaction. Cela constitue un système de réactions dites séries.
Pour une réaction possédant plusieurs étapes, la vitesse globale de formation du produit final est déterminée par la vitesse de l'étape la plus lente.
Réactions opposées
Certaines réactions peuvent se produire dans les deux sens. On les appelle des réactions opposées. Dans ce cas, le système évolue vers un état d'équilibre dynamique.
Du point de vue macroscopique, la réaction semble terminée puisque la composition du système ne varie plus. Le taux d'avancement α est alors compris entre 0 et 1 et la réaction n'est pas totale. Mais du point de vue microscopique les réactions directes et inverses continuent de se produire avec des vitesses égales.
Réactions parallèles
On appelle réactions parallèles des systèmes de réactions distinctes qui ont les mêmes réactifs mais des produits différents. La vitesse de transformation des réactifs est alors la somme des vitesse de chacune des réactions.
Les réactions complexes
Définition
Lorsqu'une réaction chimique se produit par la combinaison de plusieurs réactions élémentaires (trois au moins) qui ne correspondent pas à un des schémas des réactions composées, on dit qu'on a à faire à une réaction complexe.
Cinétique des réactions complexes
Une réaction complexe peut se décomposer en plusieurs réactions élémentaires. Il peut arriver qu'on retrouve une loi cinétique de même forme
comme cela a été précisé plus haut les exposants α et β ne sont pas nécessairement égaux aux coefficients stœchiométriques, il ne sont même pas nécessairement entiers ni positifs.
En général, plus de deux réactants interviennent dans la réaction. La loi devient alors:
où [C] est la concentration d'un des composés, et ν son coefficient stoechiométrique, pris avec le signe + si c'est un produit et - si c'est un réactif. k(T) est le coefficient de vitesse dépendant uniquement de la température. [Ai] sont les concentrations des différents réactifs. Les exposants Pi sont appelés ordre partiel de la réaction par rapport au réactif i. La somme des ordres partiels est l'ordre global de la réaction.
Les ordres partiels observés dépendent du mécanisme physique par lequel la réaction a lieu. La cinétique peut servir à étudier un tel mécanisme. Par exemple pour une réaction avec une seule étape nous avons, pour une réaction de type l A + m B → C + D:
Ici Ea est l'énergie d'activation, c'est-à-dire l'énergie par mole qui est nécessaire pour que les produits puissent réagir. Comme à une température T les molécules possèdent une énergie correspondant à la distribution de Boltzmann, on peut s'attendre à ce que la proportion de collisions avec une énergie supérieure à Ea varie suivant e-Ea/RT. Où k représente des facteurs tel que la probabilité que les molécules aient la bonne orientation lors du choc, de leurs dimensions etc.
Exemple de mécanisme complexe : H2 + Br2 -> 2HBr
La réaction entre le dihydrogène gazeux et le dibrome gazeux est un excellent exemple de réaction complexe. Dans ce cas précis, la réaction fait intervenir deux intermédiaires radicalaires H. et Br. dans une réaction en chaîne. La loi de vitesse n'a pas la forme simple d'un monôme. On dit qu'elle n'admet pas d'ordre. Voir liens externes.
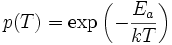
![v = \frac{-1}{a} \frac{d[A]}{dt} = \frac{-1}{b} \frac{d[B]}{dt} = \frac{1}{c} \frac{d[C]}{dt}](https://static.techno-science.net/illustration/Definitions/autres/b/bf17330687daaed72a1cdd8953aa4316_69ebd99a8cf340100368d3f34c829dc4.png)
![v_r = \frac{1}{\pm \nu} \frac{d[C]}{dt} = k(T) \prod_i [A_i]^{P_i}](https://static.techno-science.net/illustration/Definitions/autres/4/4c1bd5b505a888656428ae0420aca9a2_a87afb741de3313e198e4d08220b0506.png)
![\frac{d[C]}{dt} = ke^{-E_a/RT} [A]^{l}[B]^{m}](https://static.techno-science.net/illustration/Definitions/autres/d/d9809128650c3dee77cdafac1cd0731c_254db3360934e799611564f13aee06e9.png)

















































