Perméabilité de la barrière hémato-encéphalique - Définition
La liste des auteurs de cet article est disponible ici.
Procédés in vivo
Le premier procédé, utilisé par Paul Ehrlich pour représenter l'(im)perméabilité de la barrière hémato-encéphalique a été l'injection de colorants suivie de l'examen anatomique de l'animal. Les colorants susceptibles de franchir la barrière hémato-encéphalique colorent le milieu encéphalique de façon tenace. Le procédé est limité par le choix des colorants, et ne permet que des conclusions qualitatives. On utilise encore les colorants pour les recherches sur des lésions volontaires de la barrière hémato-encéphalique. Pour la même raison, la méthode de marquage par fluorescence – très couramment employées en microbiologie – sont totalement inadaptées pour les recherches sur les mécanismes de transport de petites molécules à la barrière hémato-encéphalique. Ce n'est que pour les très grosses molécules, comme les polypeptides, où les molécules de colorant fluorescent sont relativement petites par rapport à celle du peptide, que l'on peut utiliser le marquage par fluorescence.
Dans le passé, on a mis au point toute une série de procédés in vivo différents, que l'on trouve encore aujourd'hui en usage. En général, les méthodes in vivo sont les procédés de référence. Actuellement, on ne peut pas remplacer l'application intra-artérielle ou intra-veineuse d'un produit actif dans des conditions physiologiques réelles, puis l'analyse du tissu cérébral, par quelque procédé in vitro que ce soit, et encore moins par un calcul de simulation. Ce sont les procédés de plus haute sensibilité, avec lesquels on peut déterminer l'absorption d'une substance dans le cerveau, pendant de longues périodes, et avec de nombreuses occasions de passage à travers la barrière hémato-encéphalique.
Indice d'absorption cérébrale
Les premières tentatives pour quantifier l'absorption de substances nutritives et actives à travers la barrière hémato-encéphalique ont été mises au point en 1970 par William H. Oldendorf. Une substance marquée radioactivement est injectée avec une substance de référence également marquée, directement dans l’artère carotide de l’animal (le plus souvent un rat). Environ 5 s après l'injection, l'animal est décapité, le cerveau isolé et la concentration des substances radioactives contenues est mesurée. On calcule l'indice d'absorption cérébrale (Brain Uptake Index ou BUI) par le double rapport entre les doses radioactives de la substance T injectée et de la substance de référence R entre l'injection et la dissection :
Ce procédé, en raison de l'intervalle très court dans lequel les substances doivent être injectées et peuvent pénétrer la barrière, n'est approprié que pour des substances qui pénètrent la barrière assez rapidement. Les composés hydrophiles, comme par exemple beaucoup de peptides, ne passent que lentement. Pour ce genre de substances, la méthode est inappropriée.
Les composés à rechercher sont la plupart du temps marqués au tritium ou au carbone 14. Les substances de référence sont l'eau tritiée ou le butanol au carbone 14. Ceci permet de maintenir au minimum le volume injecté : il est nécessaire de maintenir le volume inférieur à 10 µl pour éviter les artefacts de circulation et de répartition des produits, car ceux-ci pourraient altérer la mesure du BUI. Le BUI par contre dépend peu de la concentration de la substance injectée.
| Composé | BUI [%] | log P | M (g/mol) |
| Cytosine | 1,2 | -1,72 | 243,2 |
| Urée | 1,4 | -1,52 | 60,1 |
| Mannitol | 2 | -2,11 | 182,2 |
| Thio-urée | 5 | -0,96 | 76,12 |
| Éthylène glycol | 18 | -1,3 | 62,1 |
| Acétamide | 23 | -1,1 | 59,1 |
| Méthanol | 103 | -0,52 | 32 |
| Propylène glycol | 27 | -0,92 | 76,1 |
| Éthanol | 107 | -0,18 | 46,1 |
| Butanol | 117 | 0,93 | 74,1 |
| Alcool benzylique | 94 | 1,1 | 108,1 |
| Phénobarbital | 56 | 1,42 | 232,2 |
| Phénazone | 83 | 0,38 | 188,2 |
| Caféine | 103 | 0,02 | 194,2 |
| Phénytoïne | 71 | 2,4 | 252,3 |
| Estradiol | 94 | 2,61 | 272,4 |
| Testostérone | 85 | 3,28 | 288,4 |
| Héroïne | 87 | 1,14 | 369,4 |
| Morphine | 2,6 | -0,2 | 285,3 |
| Nicotine | 120 | 0,7 | 162,2 |
Les données, sauf indication contraire, proviennent de la référence.
Indice d'efflux cérébral
Ce procédé, mis au point en 1995, permet de déterminer l'efflux d'une substance à partir du cerveau vers la circulation sanguine à travers la barrière hémato-encéphalique.
Comme pour l'indice d'absorption cérébrale, la substance à tester marquée radioactivement est injectée avec une substance de référence, radioactive aussi, directement dans le cerveau, par une microinjection. Cependant la substance de référence est choisie parmi celles les moins aptes à traverser la barrière hémato-encéphalique – souvent de l'inuline. Ici aussi, l'animal est décapité au bout d'un certain temps, et son cerveau est disséqué. La radioactivité est alors mesurée sur le même côté du cerveau (ipsilatéralement). De la fraction de la substance à tester T qui reste dans le cerveau, et similairement pour la substance de référence R, on définit l'indice d'efflux cérébral (Brain Efflux Index) BEI :
-
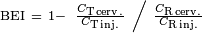
Perfusion cérébrale
Dans la technique de perfusion, la substance à tester, toujours marquée radioactivement, est perfusée dans la carotide. Puis, après le sacrifice de l’animal, le cerveau est isolé et homogénéisé, et sa radioactivité est mesurée. L'avantage de la méthode est qu'une dégradation éventuelle du sustrat dans le sang, par exemple par les enzymes qui s'y trouvent, se trouve largement empêché. Les animaux utilisés dans cette technique sont de préférence des cochons d'Inde, car leur carotide ne présente pas de bifurcation entre le cou et le cerveau, contrairement au cas du rat. Ceci permet d'élever le temps de perfusion jusqu'à 30 min, tandis que pour le rat, on ne peut pas dépasser 20 s. Cette méthode exige d'importants moyens. C'est pourquoi est n'est en réalité utilisée que pour des substances dont la stabilité dans le plasma est insuffisante, ou ne possèdent qu'une très faible possibilité de pénétrer dans le cerveau.
Une variante améliorée est la méthode d'appauvrissement de capillaires (Capillary Depletion Method). Elle consiste à séparer les capillaires du tissu nerveux par centrifugation. Ceci permet de distinguer entre une véritable perméation dans le cerveau et une simple endocytose dans l'endothélium capillaire.
Technique de diffusion d'indicateur
Dans la technique de diffusion d'indicateur (Indicator Diffusion Technique) la substance à tester est appliquée avec une substance qui n'a aucune possibilité de traverser la barrière hémato-encéphalique, dans la carotide. Les deux substances ne doivent pas être radioactivement marquées. Sur le retour du sang, par exemple sur la veine jugulaire interne, on détermine la concentration des deux substances par prise de sang et analyse du plasma. On caclule la perméation de la substance test dans le cerveau à partir de la fraction qui manque dans le sang de retour.
Cette technique ne convient pour le cerveau que pour les substances qui ont une grande capacité à franchir la barrière hémato-encéphalique.
Autoradiographie quantitative
Voir dans le Wikilivre sur la photographie, les articles spécialisés sur l'autoradiographie et la fluorographie.
La figure ci-contre montre un exemple d'autoradiographie sur un cerveau d'embryon de rat. Les domaines les plus radioactifs sont les plus sombres. C'est le cas en particulier dans la zone subventriculaire (SVZ). Ailleurs, la barrière hémato-encéphalique empêche le passage du marqueur dans le cerveau. Le trait noir donne une longueur de 2 mm. Le marquage a été réalisé avec des séquences d'oligonucléotides conjuguées avec du 35S-dATP déoxyadénosine triphosphate), liées à du GAD67 (Glutamate décarboxylase 67).
L'autoradiographie a été mise au point dans les années 1970. Dans ce procédé, on injecte en intraveineuse une substance marquée radioactivement, la plupart du temps avec du 14C. À un certain moment, les organes sont disséqués et les coupes faites au microtome à froid, et séchées, sont déposées sur un film à rayons X ou sur un détecteur à scintillation à haute résolution. Par le degré de noircissement, ou respectivement la dose de radiation détectée, on peut mesurer l'absorption de la substance test dans le cerveau, après une calibration par exemple avec de l'albumine marquée à l’iode-125. Ceci s'applique aussi bien au cerveau qu'à d'autres organes. Si l'on mesure par d'autres moyens la quantité de sang irriguant la région examinée, on accède par le calcul au produit perméabilité-surface.
Microdialyse intracérébrale
Pour la microdialyse intracérébrale, on implante dans le tissu nerveux une membrane hémiperméable. Par un microcathéter se terminant dans cette membrane, on peut perfuser des substances. Dans la foulée, on recueille par le même cathéter des échantillons du liquide interstitiel et on les analyse.
On peut ainsi pratiquer sur des animaux de nombreuses recherches et expériences sur la barrière hémato-encéphalique. Par exemple, l'ouverture décrite ci-après de la barrière par une solution hypertonique.
Cette métode est bien adaptée aux prises de liquide continues. On peut établir ainsi le profil de la concentration dans le temps de substances injectées par voie intra-veineuse ou intra-artérielle.
Les expériences les plus variées pour étudier les mécanismes de transport à la barrière hémato-encéphalique peuvent être conduites au moyen de la microdialyse intracérébrale.
En médecine humaine, la microdialyse intracérébrale est utilisée pour le monitoring neurochimique en cas d'accident vasculaire cérébral.
Procédés d'imagerie
Au moyen des procédés d'imagerie, on peut avoir de façon non invasive une représentation et une mesure de la perméabilité de la barrière hémato-encéphalique pour diverses substances. Ces procédés sont en partie utilisés en pratique clinique pour la médecine humaine. Nous ne serons pas intéressés ici par la radiographie ni même par la tomodensitométrie, son perfectionnement, car ils ne sont essentiellement sensibles qu'aux os du crâne. Les principaux en ce qui nous concerne ici sont la tomographie par émission de positons (TEP), l'imagerie par résonance magnétique (IRM) et la spectroscopie par résonance magnétique (SRM).
La tomographie par émission de positons
Avec la tomographie par émission de positons, on représente dans l'essentiel pour l'étude de la barrière hémato-encéphalique les processus d'efflux de substances potentiellement actives par la P-glycoprotéine. La compréhension de la fonction de la P-glycoprotéine et des influences exercées sur elle à la barrière hémato-encéphalique est de grande importance pour la mise au point de médicaments psychotropes. Ces recherches fondamentales sont menées avec des substances marquées avec un émetteur de positons (désintégration bêta+ – β+). La plupart du temps, il s'agit du carbone-11 (11C). Pour des composés fluorés, on préfère utiliser le fluor-18 (18F) à courte période. En raison des courtes demi-vies de ces isotopes (20,39 min pour le 11C et 110 min pour le 18F), ces expériences ne peuvent être faites que dans des instituts de recherche proches d'un cyclotron. Par exemple, on a pu ainsi marquer et étudier le vérapamil, le carazolol, le lopéramide. Le vérapamil est d'un intérêt pharmacologique particulier, car il semble capable d'inhiber la P-glycoprotéine.
La TEP est l'une des rares méthodes, qui permette une comparaison directe in vivo entre des organismes utilisés en phase préclinique et le patient, en ce qui concerne l'interaction entre la substance active et la P-glycoprotéine.
Imagerie par résonance magnétique (IRM)
L'imagerie par résonance magnétique (IRM), en tant que procédé d'imagerie, est trop insensible pour représenter le passage des substances actives à travers une barrière hémato-encéphalique saine. Il en va tout autrement en cas de lésion. Dans ce cas, l'IRM avec produit de contraste joue un grand rôle pour diverses maladies neurodégératives ou cancéreuses dans le domaine du cerveau. Ceci est abordé dans l’article sur les maladies directement associées avec la barrière hémato-encéphalique.
Spectroscopie par résonance magnétique (SRM)
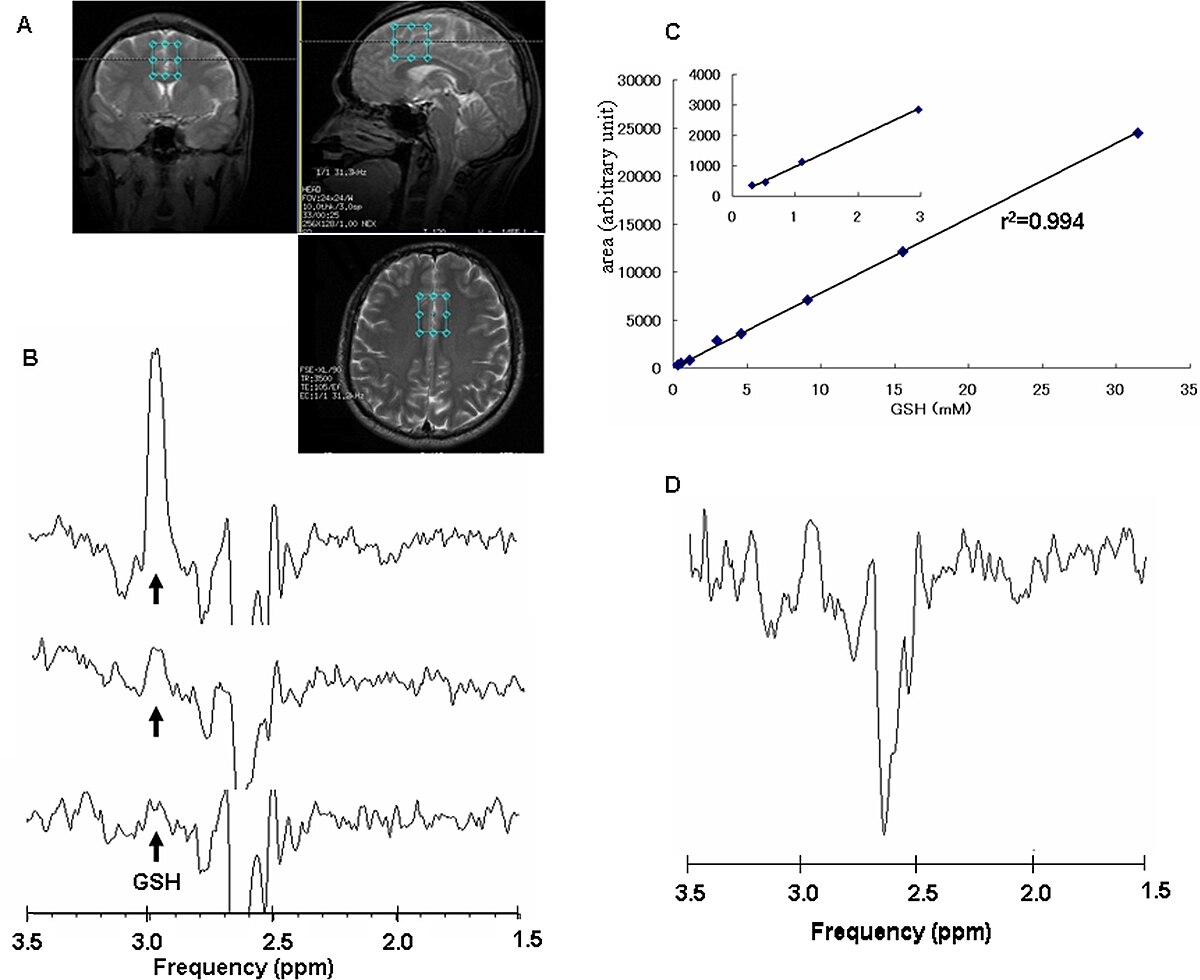
La SRM est basé sur la résonance magnétique nucléaire, qui permet au travers d'un tomographe à résonance magnétique la spectroscopie en résonance magnétique. Ceci permet de prouver la présence de cerrtaines substances dans le cerveau, ainsi que de leurs produits de réaction, de façon quantitative. Par rapport à l’IRM qui se base sur les spins des protons de l’eau, on s'y intéresse à d'autres noyaux atomiques, notamment 19F, 13C, 31P, ainsi que des protons dans des matières autres que l'eau. Par comparaison avec les protons de l'eau présents en bien plus grandes quantité, les noyaux étudiés, parfois présents uniquement en traces, donnent des signaux bien plus faibles. La résolution spatiale correspond à un voxel (élément de volume séparé) de l’ordre de 1 cm3. On combine facilement la SRM et l'IRM : l'IRM précise la structure anatomique, et la SRM la composition corrélative. On peut par exemple étudier avec la SRM qualitativement et quantitativement la pharmacocinétique des composés fluorés, comme les neuroleptiques trifluopérazine ou fluphénazine, dans le cerveau humain. La spectroscopie par résonance magnétique permet de distinguer quantiativement entre le médicament et ses métabolites. De même, on peut faire la différence entre les états libres et liés de la substance.
Les inconvénients de la SRM sont les longs temps de mesure et la faible résolution spatiale, dus à la faible sensibilité de la méthode. Le dernier point est particulièrement problématique quand il s'agit d'expérience sur de petits animaux.