Azote - Définition
| Données | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Général | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, Symbole, Numéro | Azote, N, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Série chimique | Non-métaux | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, Période, Bloc | 15 (VA), 2, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 1,2506 kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | Incolore | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 14,0067 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc) | 65 (56) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de covalence | 75 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de van der Waals | 155 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [He]2s22p3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d'énergie | 2, 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État(s) d'oxydation | +3,5,4,2,0,-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxyde | Acide fort | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structure cristalline | Hexagonale | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | Gaz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Température de fusion | 63,14 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Température de vaporisation | 77,35 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 0,3604 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 2,7928 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 13,54×10-3 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de la vapeur | ND | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vélocité du son | 334,5 m/s à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité (Pauling) | 3,04 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur massique | 1 040 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité électrique | ND S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 0,02598 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1er potentiel d'ionisation | 1 402,3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2e potentiel d'ionisation | 2 856 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3e potentiel d'ionisation | 4 578,1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4e potentiel d'ionisation | 7 475 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
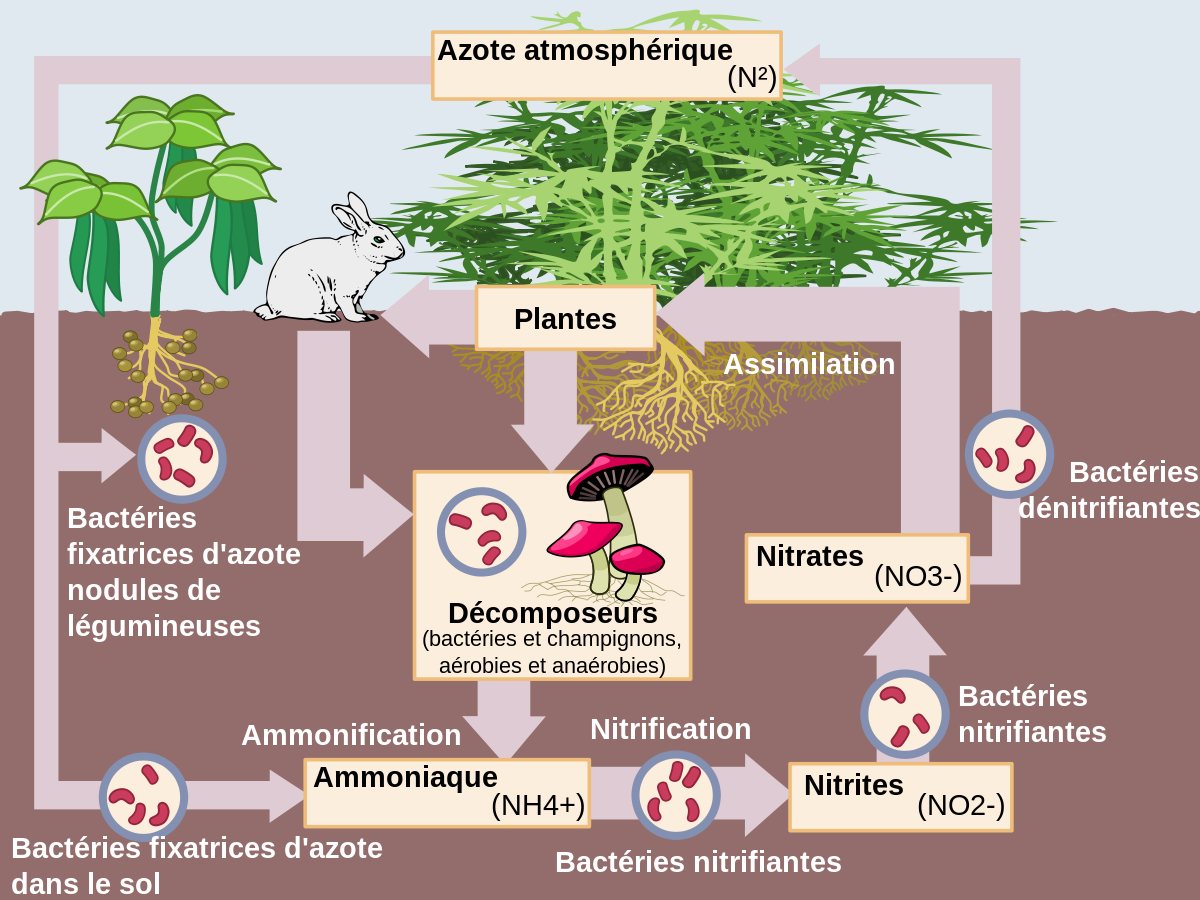
L'azote désigne un élément chimique de la famille des pnictogènes, de symbole N et de numéro atomique 7.
Dans le langage courant, l'azote désigne le gaz diatomique diazote N2, constituant majoritaire de l'atmosphère terrestre, représentant presque les 4/5e de l'air.
L'azote est le 34e élément constituant la croûte terrestre par ordre d'importance.
Histoire
Le nom latin " nitrogenium " provient du grec nitron gennan, ce qui signifie " formateur de salpêtre " (nitrate de potassium). Le symbole chimique N provient de cette origine.
Le terme anglais pour désigner l'azote est nitrogen. Il existe aussi le nom nitrogène en français, mais l'appelation azote est la plus fréquente.
Antoine Lavoisier a choisi le nom azote, composé de a- (privatif) et du radical grec ζωτ-, " vivant " et signifie donc " privé de vie ", du fait que contrairement à l'oxygène, il n'entretient pas la vie des animaux.
L'azote a été isolé par Daniel Rutherford en 1772, cependant les composés azotés sont connus depuis l'antiquité. On le préparait en extrayant de l'air le dioxygène et le dioxyde de carbone.
Propriétés
Propriétés physiques
À la pression atmosphérique normale :
- l'azote se condense (ou se vaporise) à − 196°C ;
- sa viscosité est de 1,75×10-5 Pa.s à 20°C ;
- sa solubilité dans l'eau à pression atmosphérique, égale à 22,0×10-6 mol/L à 15°C, est la moitié de celle de l'oxygène.
Exploitation
- allié à 50% d'Argon dans les réservoirs d'extinction d'incendie
Gaz (diazote)
Aujourd'hui, l'azote gaz (le diazote) est généralement obtenu par liquéfaction de l'air, dont il est le principal constituant avec une concentration de 78,06 % en volume et de 75,5 % en poids.
La production mondiale est d'environ 150 millions de tonnes par an.
Composés
L'azote est essentiellement exploité en tant qu'engrais que l'on tire des minéraux, de l'urée ou du guano (excréments d'oiseaux séchés), ou bien que l'on produit par synthèse chimique. Les régions d'exploitation sont le Chili, le Pérou, l'Inde, la Bolivie, l'Espagne, l'Italie et la Russie.
L'élément chimique azote entre dans la composition des protéines (pour environ 15 %).
Les minéraux contenant de l'azote sont essentiellement les nitrates : nitrate de potassium KNO3 (constituant du salpêtre), nitrate de sodium NaNO3 (constituant du salpêtre du Chili).
Utilisations
Diazote
Il est également utilisé dans les musées pour créer des chambres sous atmosphère inerte confinée, dans le but de conserver des objets antiques sensibles à certains insectes parasites. Il est particulièrement utilisé pour les cadres en bois des tableaux anciens, les incunables, les parchemins, les objets en bois, d'une part pour éliminer les éventuels vers à bois et d'autre part pour stopper et interdire toute infestation (Petite vrillette).
Le gaz diazote est utilisé pour le gonflage de pneumatiques. Bien que l'air contienne déjà 78 % d'azote (de diazote pour être plus précis), certains professionnels de l'aviation ou de la formule 1, (par exemple), augmentent cette proportion et gonflent les pneumatiques avec de l'azote presque pur. Ce gaz ayant la propriété d'être inerte et stable conserve une pression plus constante même en cas d'échauffement intense du pneumatique. De plus ce gaz fuit plus difficilement. Une polémique existe d'ailleurs quant à l'introduction de cette méthode pour les véhicules particuliers. En effet, ceux-ci sont soumis à des contraintes bien moindres ce qui rend la différence avec l'air moins notable. Par contre le gonflage devient payant et on lui reproche souvent d'avoir un prix non justifié (le gonflage à l'air est souvent gratuit et jugé satisfaisant). Ceux qui l'utilisent malgré tout devraient avoir, en principe, à rectifier le gonflage plus rarement, mais ils gardent toutefois l'obligation de contrôler les pressions régulièrement. Il est également utilisé pour gonfler les accumulateurs hydrauliques en raison de sa passivité vis à vis des huiles.
Le diazote est également utilisé dans les installations d'extinction automatique à gaz, parfois en association avec de l'argon ou du dioxyde de carbone, qui protègent des salles informatiques ou des stockages particuliers. Conservé dans des bonbonnes métalliques sous une pression d'environ 200 bars, il est libéré dans un local où un début d'incendie a été détecté. Le volume de diazote injecté remplace une partie de l'atmosphère de la pièce et entraine une chute du taux d'oxygène dans l'air. Le niveau généralement retenu de 15 % de comburant interrompt le phénomène de combustion sans effet létal sur la respiration humaine.
Le diazote, contrairement aux gaz inhibiteurs chimiques halogénés, ne présente aucun effet nocif pour l'environnement (effet de serre, couche d'ozone). En revanche, il requiert un stockage volumineux, demande des canalisations adaptées et des mesures constructives pour faire face à la détente brutale d'un équivalent de 40 à 50 % du volume protégé.
Composés
Les autres utilisations concernent des composés azotés tels que :
- des fertilisants agricoles (engrais). La plupart des plantes ne sont pas capables d'absorber directement l'azote. Ce dernier est donc fourni sous forme d'engrais chimique azoté. Quelques exemples d'engrais chimiques azotés sont le nitrate d'ammonium, NH4NO3, le sulfate d'ammonium, (NH4)2SO4, le monophosphate d'ammonium, NH4H2PO4, l'urée, CO(NH2)2 ;
- des produits pharmaceutiques :
- certains nitrates organiques, telle la nitroglycérine, sont utilisés pour soigner certaines affections cardiovasculaires ;
- le protoxyde d'azote (gaz hilarant) est utilisé comme anesthésiant ;
- l'ammoniac NH3, utilisé comme matière première de production de polymères, d'explosifs, d'engrais, ou comme fluide réfrigérant dans certains installations industrielles ;
- des combustibles (l'hydrazine et autres dérivés comme combustibles de fusée) ;
- des explosifs (composés chimiques organiques qui possèdent plusieurs groupes -ONO2 ou -NO2 : dynamite).
- des gaz propulseurs pour aérosols (N2O) ;
- des conservateurs (E250, NaNO2).