Électron - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Électron | |
| Propriétés générales | |
|---|---|
| Classification | Fermion |
| Composition | Élémentaire |
| Groupe | Lepton |
| Génération | 1ère |
| Propriétés physiques | |
| Masse | 510,998 918 (44) keV.c-2 |
| Charge électrique | -1 e |
| Spin | 1/2 |
| Durée de vie | Stable (expérimentalement, supérieure à 4,6.1026 années) |
| Historique | |
| Prédiction | Stoney (1874) |
| Découverte | Thomson (1897) |
L'électron est une particule élémentaire de la famille des leptons. Il possède une charge électrique élémentaire de signe négatif. C’est l’un des composants de l’atome avec les neutrons et les protons.
Le concept d’une quantité indivisible de charge électrique a été élaboré dès 1838 par le naturaliste britannique Richard Laming afin d’expliquer les propriétés chimiques des atomes. Le nom d’« électron » pour cette charge est dû au physicien irlandais George Stoney. L’électron a ensuite été identifié comme le corpuscule envisagé par J. J. Thomson et son équipe de physiciens britanniques en 1897, suite à leurs travaux sur les rayons cathodiques.
Histoire
Les anciens Grecs avaient déjà remarqué que l'ambre attire les petits objets quand elle a été frottée avec de la fourrure ; à part la foudre, ce phénomène est la plus ancienne expérience de l'humanité notée en rapport avec l'électricité. Dans son traité de 1600 De Magnete, le médecin anglais William Gilbert forge le mot bas-latin electricus, pour désigner cette propriété d'attirer les petits objets après frottement. Les mots « électrique » et « électricité » sont dérivés du latin ēlectrum (aussi racine de l'alliage métallique électrum), dérivé à son tour du mot grec ἤλεκτρον (êlectron´) pour ambre.
En 1737, C. F. du Fay et Hawksbee découvrent que ce qu'ils croyaient être deux sortes d'électricité : celle engendrée en frottant du verre, et celle engendrée en frottant la résine. À partir de là, du Fay conclut que l'électricité consiste de deux fluides électriques, « vitreux » et « résineux », que l'on sépare par frottement, et que l'on peut recombiner ensemble. Une décennie plus tard, Benjamin Franklin propose que l'électricité n'est pas différente des divers types de fluide électrique, mais le même, sous des pressions différentes. Il leur donne la nomenclature moderne de charge positive ou négative respectivemement.
Entre 1838 et 1851, le naturaliste britannique Richard Laming (en) développe l'idée qu'un atome est composé d'un noyau de matière, entouré par des particules subatomiques qui ont une charge électrique unité. À partir de 1846, le physicien allemand Wilhelm Eduard Weber émet la théorie que l'électricité est composée de fluides chargés positivement et négativement, et que leur interaction est régie par une loi en carré inverse. Après avoir étudié le phénomène d'électrolyse en 1874, le physicien irlandais George Stoney suggère qu'il existe « une seule quantité définie d'électricité », la charge d'un ion monovalent. Il était alors capable d'estimer la valeur de cette charge élémentaire e à partir des lois de l'électrolyse de Faraday. Cependant, Stoney croyait que ces charges étaient attachées de façon permanente aux atomes, et ne pouvaient leur être enlevées. En 1881, le physicien allemand Hermann von Helmholtz argumenta que les charges positives et négatives étaient composées de parties élémentaires, chacune « se comportant comme des atomes d'électricité ».
En 1894, Stoney forge le terme d'« électron » pour désigner ces charges élémentaires, disant « ... une estimation a été faite de la valeur réelle de cette unité fondamentale très remarquable d'électricité, pour laquelle je me suis risqué à proposer le nom d'« électron » ». Le mot électron est une combinaison du mot électrique et du suffixe -on, le dernier étant maintenant utilisé pour désigner une particule subatomique, comme le proton ou le neutron.
Découverte

Le physicien allemand Johann Wilhelm Hittorf entreprend l'étude de la conductivité dans les gaz raréfiés. En 1869, il découvre une lueur émise par la cathode, dont la taille croît quand la pression du gaz diminue. En 1876, le physicien allemand Eugen Goldstein montre que les rayons de cette lueur provoquent une ombre, et il les appelle rayons cathodiques. Pendant les années 1870, le chimiste et physicien anglais Sir William Crookes met au point le premier tube à rayons cathodiques avec un vide poussé à l'intérieur. Puis il montre que les rayons luminescents apparaissant dans le tube transmettent de l'énergie, et se déplacent de la cathode vers l'anode. De plus, en appliquant un champ magnétique, il est capable de défléchir les rayons, montrant par là que le faisceau se comporte comme s'il est chargé négativement. En 1879, il propose que ces propriétés sont expliquées par ce qu'il appelle « matière radiante ». Il suggère que c'est un quatrième état de la matière, consistant en molécules chargées négativement, projetées à grande vitesse de la cathode.
Le physicien britannique né allemand Arthur Schuster développa les expériences de Crookes en disposant des plaques de métal parallèlement aux rayons cathodiques, et en appliquant une différence de potentiel électrique entre les plaques. Le champ électrique défléchit les rayons vers la plaque chargée positivement, ce qui renforce la preuve que les rayons portent une charge négative. En mesurant la déflexion selon la différence de potentiel, Schuster est capable en 1890 de mesurer le rapport masse sur charge des composantes des rayons. Cependant, ceci donna une valeur plus de mille fois plus faible que la valeur attendue, si bien que l'on n'accorda que peu de confiance à son calcul à l'époque.
En 1896-1897, le physicien britannique J. J. Thomson, et ses collègues John S. Townsend (en) et H. A. Wilson (en) réalisent des expériences indiquant que les rayons cathodiques sont effectivement des particules individualisées, plutôt que des ondes, des atomes ou des molécules comme il était cru avant. Thomson fait de bonnes estimations à la fois de la charge e et de la masse m, trouvant que les particules des rayons cathodiques, qu'il appelle « corpuscules », ont environ un millième de la masse de l'ion le plus léger connu alors : l'hydrogène. Il montre que le rapport charge sur masse e/m est indépendant de la matière de la cathode. Il montre en plus que les particules chargées négativement produites par les matériaux radioactifs, les matières chauffées et les matières illuminées sont universellement les mêmes. Le nom d'électron a été reproposé par le physicien irlandais George F. Fitzgerald, ce qui a été maintenant accepté universellement.
En étudiant les minéraux naturellement fluorescents, le physicien français Henri Becquerel découvre que ceux-ci émettent des rayonnements en l'absence de toute source d'énergie externe. Ces matériaux radioactifs deviennent le sujet de beaucoup d'intérêt de la part des scientifiques, y compris le physicien néo-zélandais Ernest Rutherford, qui découvre qu'ils émettent des particules. Il désigne ces particules sous le nom de particules alpha et bêta, selon leur pouvoir de pénétrer à travers la matière. En 1900, Becquerel montre que les rayons bêta émis par le radium sont défléchis par un champ électrique, et que leur rapport masse sur charge est le même que celui des rayons cathodiques. Cette preuve renforçait l'idée que les électrons existent comme composants des atomes.
La charge de l'électron est mesurée de façon plus précise par le physicien américain Robert Millikan par son expérience sur la goutte d'huile de 1909,, dont il publie les résultats en 1911. Cette expérience utilise un champ électrique pour empêcher une goutte d'huile chargée de tomber sous l'action de la pesanteur. Ce système pouvait mesurer la charge électrique depuis quelques ions jusqu'à 150, avec une marge d'erreur de moins de 0,3%. Des expériences comparables avaient été faites plus tôt par le groupe de Thomson, en utilisant des brouillards de gouttelettes d'eau chargées par électrolyse et en 1911 par Abram Ioffé, qui a obtenu indépendamment le même résultat que Millikan en utilisant des microparticules de métal, et publia ses résultats en 1913. Cependant, les gouttes d'huile étaient plus stables que les gouttes d'eau à cause de leur évaporation plus lente, et elles se prêtaient mieux à des expériences de longue durée.
Vers le début du XXe siècle, on trouve que sous certaines conditions, une particule rapide provoque la condensation d'une vapeur d'eau sursaturée le long du trajet. En 1911, Charles Wilson utilise ce principe pour mettre au point sa chambre à brouillard, qui permet de photographier les traces de particules chargées, comme des électrons rapides.
Théorie de l'atome
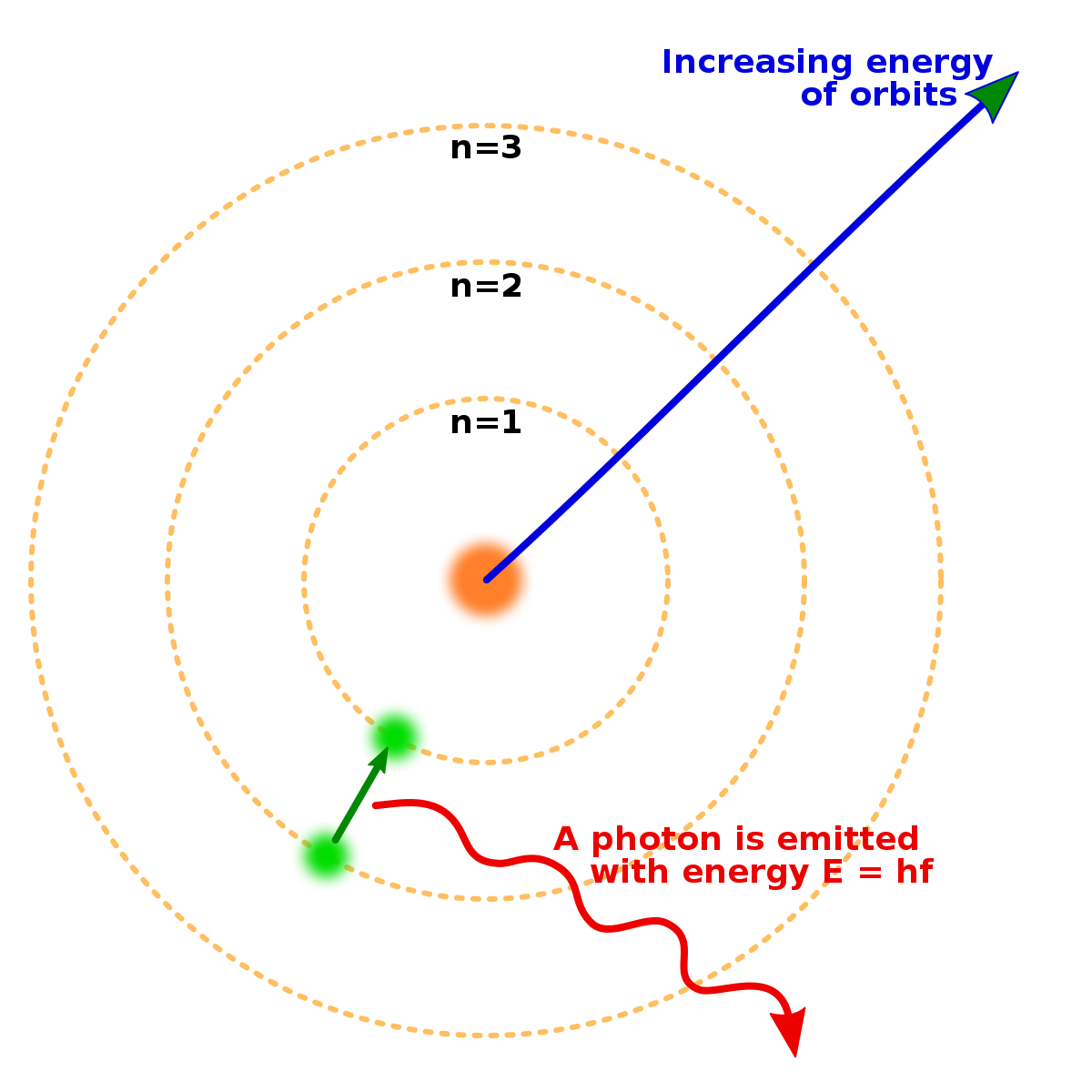
En 1914, les expériences des physiciens Ernest Rutherford, Henry Moseley, James Franck et Gustav Hertz avaient solidement établi la structure de l'atome comme un noyau positivement chargé entouré d'électrons de masse plus faible. En 1913, le physicien danois Niels Bohr postule que les électrons sont dans des états quantifiés, dont l'énergie est déterminée par le mouvement angulaire autour du noyau. Les électrons peuvent passer d'un état à l'autre, par émission ou absorption de photons à des fréquences spécifiques. Au moyen de ces orbites quantifiées, il explique précisément les raies spectrales de l'atome d'hydrogène. Cependant, le modèle de Bohr n'arrivait pas à rendre compte des intensités relatives des raies spectrales, et pas non plus à expliquer les spectres d'atomes plus complexes.
Les liaisons chimiques entre atomes sont expliqués par Gilbert Lewis, qui propose en 1916 que la liaison covalente entre atomes est maintenue par une paire d'électrons qu'ils se partagent. Plus tard, en 1927, Walter Heitler et Fritz London donnent toute l'explication de la formation de paire d'électrons et de liaison chimique en termes de mécanique quantique.
En 1919, le chimiste américain Irving Langmuir avait raffiné le modèle statique d'atome de Lewis, et suggéré que tous les électrons étaient distribués en « couches concentriques (à peu près) sphériques, toutes de même épaisseur ». Les couches étaient à leur tour divisées en un certain nombre de cellules, chacune contenant une paire d'électrons. Avec ce modèle, Langmuir arrivait à expliquer qualitativement les propriétés chimiques de tous les éléments de la table périodique, que l'on savait se ressembler assez, selon la loi de similitude.
En 1924, le physicien autrichien Wolfgang Pauli remarqua que la structure en couches de l'atome pourrait être expliquée par un ensemble de quatre paramètres, qui définissait tous les états en énergie, aussi longtemps que chaque état n'était occupé que par un seul électron. (Cette interdiction faite à deux électrons d'occuper le même état est devenu connue sous le nom de principe d'exclusion de Pauli.) Le mécanisme physique pour expliquer le quatrième paramètre, qui peut prendre deux valeurs, a été fourni par les physiciens néerlandais Samuel Goudsmit et George Uhlenbeck, quand ils ont suggéré que l'électron, outre le moment angulaire de son orbite, pourrait avoir un moment angulaire intrinsèque. Cette propriété devint connue sous le nom de spin, et elle expliquait le dédoublement des raies spectrales observé avec un spectrographe à haute résolution, qui était resté mystérieux jusque là ; ce phénomène est connu sous le nom de structure hyperfine des raies.
La mécanique quantique
Les électrons, comme toute la matière, ont les propriétés quantiques d'être à la fois onde et corpuscule, si bien qu'ils peuvent avoir des collisions avec d'autres particules, et être diffractés comme la lumière. Cependant cette dualité est montrée plus facilement avec les électrons, en raison de leur faible masse. Puisqu'un électron est un fermion, c'est à dire qu'il satisfait au principe d'exclusion de Pauli.
Dans sa dissertation « Recherches sur la théorie des quanta », le physicien français Louis de Broglie émet l'hypothèse que toute matière possède une onde de de Broglie semblable à la lumière. C'est-à-dire que sous des conditions appropriées les électrons et autres particules matérielles montrent les propriétés soit de particules soit d'ondes. Les propriétés corpusculaires d'une particule sont démontrées quand elle apparaît localisée à un endroit dans l'espace le long d'une trajectoire à tout moment. La nature ondulatoire est observée, par exemple, quand un faisceau passe à travers des fentes parallèles et crée des figures d'interférence. En 1927, l'effet d'interférence avec un faisceau d'électrons est démontré par le physicien anglais George Paget Thomson, au moyen d'un mince film métallique, et par les physiciens américains Clinton Davisson et Lester Germer en utilisant un cristal de nickel.
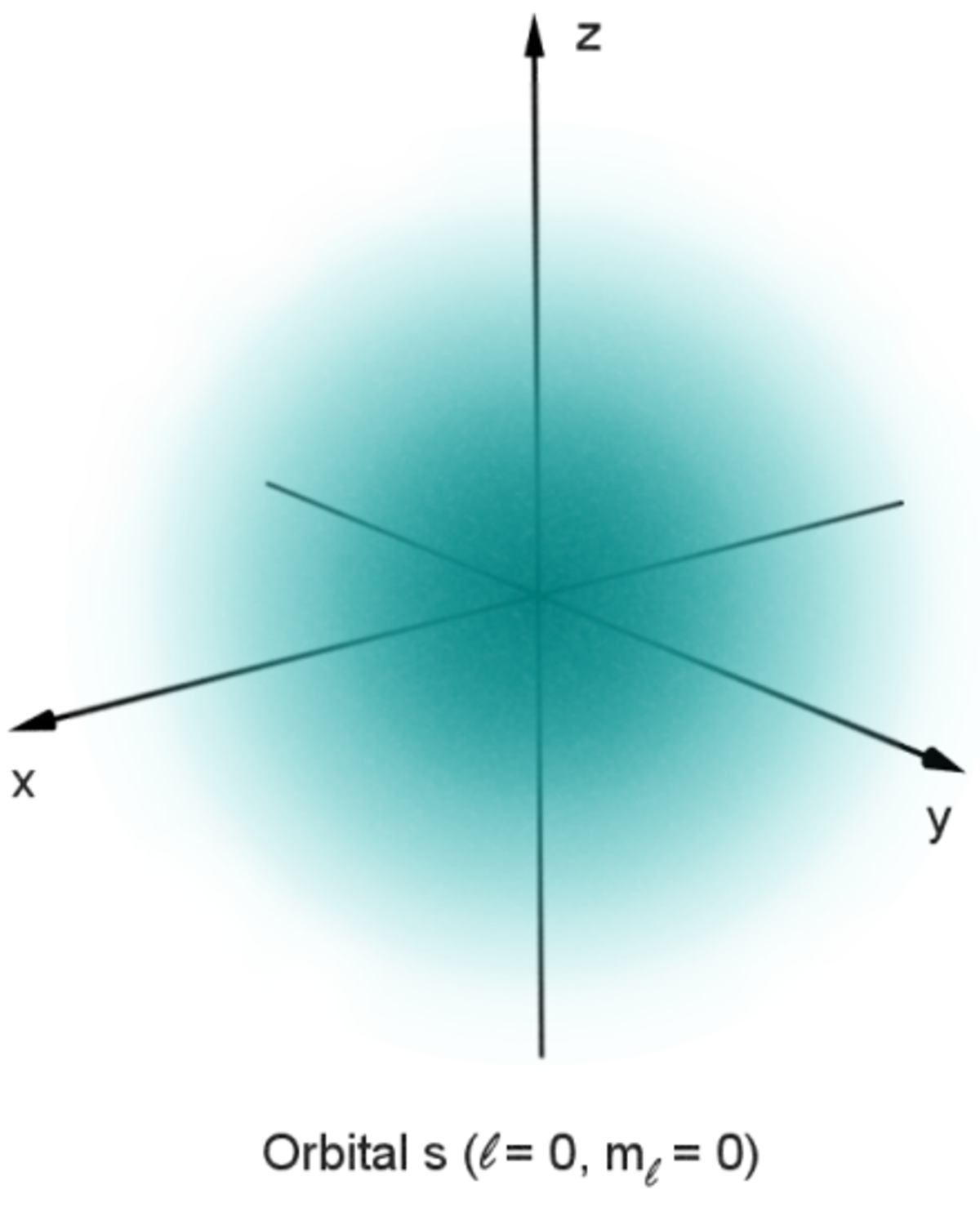
Le succès de la prédiction de de Broglie conduisit à la publication par Erwin Schrödinger en 1926, de l'équation de Schrödinger qui décrit avec succès la propagation des ondes d'électrons. Plutôt que d'avoir une solution donnant la position d'un électron dans le temps, cette équation d'onde peut être utilisée pour prédire la probabilité de trouver un électron près d'un endroit. Cette approche a été ultérieurement nommée mécanique quantique, et a donné une très bonne approximation des états d'énergie dans l'atome d'hydrogène. Une fois que le spin et les interactions entre les divers électrons ont été pris en compte, la mécanique quantique permet avec succès le calcul des électrons dans des atomes avec un numéro atomique plus élevé que le 1 de l'hydrogène.
En 1928, améliorant le travail de Wolfgang Pauli, Paul Dirac produit un modèle de l'électron – l'équation de Dirac, compatible avec la théorie de la relativité, en appliquant des considérations de symétrie et de relativité à la formulation hamiltonienne de la mécanique quantique du champ électromagnétique. Pour résoudre certains problèmes avec son équation relativiste, en 1930, Dirac développe un modèle de vide avec une mer infinie de particules d'énergie négative, parfois nommé « mer de Dirac ». Ceci le conduit à prédire l'existence du positron, semblable à l'électron dans l'antimatière. Cette particule avait été découverte par Carl D. Anderson, qui a proposé d'appeler les électrons standard « négatrons » et d'utiliser le terme électron comme générique pour désigner les variantes des deux charges. Cet usage du terme négatron est encore rencontrée à l'occasion aujourd'hui, et peut être abrégée en négaton.
En 1947, Willis Lamb, en collaboration avec le thésard Robert Retherford, trouve que certains états quantiques de l'atome d'hydrogène, qui devraient avoir la même énergie, sont décalés, le décalage étant connu sous le nom décalage de Lamb ou sous l'original anglais de Lamb shift. À à peu près le même moment, Polykarp Kusch, travaillant avec Henry M. Foley, découvre que le moment magnétique de l'électron est un peu plus grand que celui prédit par la théorie de Dirac. Cette petite différence sera ultérieurement appelée moment magnétique anomal de l'électron. Pour résoudre ces problèmes, une théorie plus élaborée, appelée électrodynamique quantique est mise au point par Sin-Itiro Tomonaga, Julian Schwinger et Richard Feynman à la fin des années 1940.
Accélérateurs de particules
Avec le développement des accélérateurs de particules pendant la première moitié du XXe siècle, les physiciens ont commencé à entrer plus à fond dans les propriétés des particules subatomiques. Les premières tentatives pour accélérer des électrons en utilisant l'induction électromagnétique ont été faites avec succès en 1942 par Donald Kerst. Son bétatron initial atteint une énergie de 2,3 MeV, alors que les bétatrons suivants finissent par atteindre 300 MeV. En 1947, le rayonnement synchrotron est découvert, avec un synchrotron à électrons de 70 MeV chez General Electric. Ce rayonnement est provoqué par l'accélération des électrons se déplaçant à une vitesse proche de celle de la lumière.
Avec une énergie de faisceau de 1,5 GeV, le premier collisionneur de particules à haute énergie est ADONE, qui commence à fonctionner en 1968. Cet appareil accélère des électrons et des positrons en sens inverse, ce qui fait plus que doubler l'énergie dans leur collision, comparée à la collision de l'un des faisceaux avec une cible immobile, en raison de la perte d'énergie provoquée par le recul inévitable de la cible. Le grand collisionneur électron-positon, plus connu sous son acronyme anglais LEP au CERN, qui a fonctionné de 1989 à 2000, a atteint des énergies de collisions de 209 GeV et réalisé des mesures importantes pour le modèle standard de la physique des particules